LA CARDIOMIOPATIA
IPERTROFICA
La cardiomiopatia ipertrofica è una malattia del muscolo cardiaco, caratterizzata da un marcato aumento dello spessore delle pareti del cuore, in particolare del ven- tricolo sinistro. Nella stragrande maggioranza dei casi la malattia ha un’ origine genetica.

In pratica in circa il 60% dei casi è possibile trovare una mutazione genetica in uno dei geni che codificano per le proteine del sarcomero. Sono state riconosciute alcune centinaia di mutazioni in 13 geni;i principali geni implicati sono quelli che codificano la catena pesante della miosi-na, la proteina C legante la miosina e la Troponina T. La prevalenza della malattia nella popolazione adulta gene-rale è di circa 1:500. Le alterazioni cardiache associate alla cardiomiopatia ipertrofica differiscono da paziente a paziente; mentre alcuni pazienti presentano un lieve aumento dello spessore delle pareti del ventricolo sini-stro,altri pazienti possono raggiungere uno spessore del-le pareti >3 volte i valori della normalità.
I pazienti che non hanno sintomi hanno un decorso favo- revole, mentre altri sviluppano sintomi tipici dell'insuffi-cienza cardiaca, oppure angina pectoris, aritmie ventrico-lari ed alcuni possono avere eventi gravi ed improvvisi come la morte improvvisa.Nel 20-25% dei pazienti è pre-sente un ostacolo allo svuotamento del ventricolo sini-stro. Questo ostacolo è causato sia dall’aumento dello spessore delle pareti del ventricolo sinistro che da un anomalo comportamento della valvola mitrale che inter-ferisce con il flusso sanguigno.Questa forma di cardio-miopatia ipertrofica viene definita “ostruttiva” ed è asso-ciata ad un decorso clinico meno favorevole,in quanto sviluppano sintomi d’insufficienza cardiaca. I pazienti con sintomi importanti che non rispondono alla terapia me-dica sono candidati a intervento chirurgico di “miecto-mia”,che consiste nell’asportare una porzione del musco-lo ispessito e normalizzare la funzione della valvola mi-trale, abolendo l’ostruzione allo svuotamento della cavità.

Terapia
La terapia medica è diretta principalmente contro l'ano-mala distensibilità diastolica.
I β-bloccanti (evitare i β-bloccanti con attività simpatico-mimetica intrinseca come pindololo, oxprenololo, acebu-tololo) e i calcioantagonisti (verapamil) da soli o in asso-ciazione sono i farmaci utilizzati diffusamente in quanto favoriscono un aumento delledimensioni della cavità ven-tricolare sinistra e diminuiscono l'ostruzione all'efflusso, migliorando la funzione diastolica del ventricolo sinistro. Inoltre con il loro effetto cronotropo negativo rallentano la frequenza cardiaca, prolungando il tempo di riempi-mento diastolico e riducendo così l'entità dell'ostruzione del tratto di efflusso.
I farmaci che riducono il precarico come nitrati, diuretici, ACE-inibitori, antagonisti dell'angiotensina causano una riduzione delle dimensioni del ventricolo e provocano un peggioramento dei sintomi.
Mentre i glicosidi digitalici e le catecolamine sono controindicati in quanto inducono addirittura un peg-gioramento dell'ostruzione del tratto di efflusso, non riducono l'elevata pressione telediastolica e possono favorire le aritmie.
Tra gli antiaritmici l’amiodarone sembra che possa ridur- re la mortalità in particolare nei pazienti con tachiaritmie ventricolari non sostenute o sincope. L' azione antifibrilla-toria dei β-bloccanti può aiutare a prevenire la morte improvvisa. La disopiramide farmaco della Classe IA, ha un effetto inotropo negativo ed è stata usata come an-tiaritmico e come farmaco inotropo negativo.
In alcuni pazienti con ostruzione del tratto di efflusso so- no stati utilizzati pace-maker bicamerali per modificare il pattern di depolarizzazione del ventricolo.Nella maggior parte dei casi, si è ridotta la gravità dell'ostruzione e la sintomatologia è migliorata. L'effetto a lungo termine di questo trattamento e l'impatto sulla mortalità richiedono ulteriori studi.
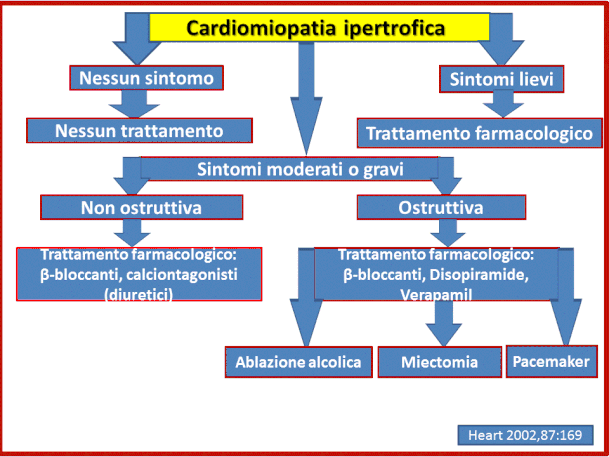
In sintesi il trattamento dei pazienti affetti da miocar-diopatia ipertrofica è diretto ad alleviare i
sintomi, a prevenire le complicanze e a ridurre il rischio di mor-te improvvisa. Nella figura sottostante viene presen-tato l'algoritmo del trattamento clinico nel paziente con
miocardiopatia ipertrofica.
INDICAZIONI ALL’IMPIANTO DEL DEFIBRILLATORE AUTOMATICO NELLA CARDIOMIOPATIA IPERTRO- FICA
L’impianto di un defibrillatore impiantabile (ICD) è il solo trattamento che si è dimostrato efficace nella preven- zione della morte improvvisa nella cardiomiopatia iper- trofica.
Quando porre le indicazioni in considerazione che si trat-ta di un approccio terapeutico invasivo?
Prevenzione secondaria della morte improvvisa
Un precedente arresto cardiaco od uno o più episodi di tachicardia ventricolare sostenuta od emodinamicamente significativa sono considerati predittori di rischio elevato e costituiscono un’indicazione all’impianto di un defibril-latore impiantabile per prevenzione secondaria della morte improvvisa.
Prevenzione primaria della morte improvvisa
La decisione di impiantare un ICD deve essere basata su una valutazione del rischio di ogni singolo paziente.I prin-cipali indicatori di rischio comprendono:
1)storia familiare di morte improvvisa;
2)ipertrofia ventricolare sinistra massiva ( ≥ 30 mm);
3) sincope di origine non spiegata (non vasovagale);
4)tachicardia ventricolare non sostenuta durante registra- zione Holter;
5)comportamento anormale della pressione arteriosa du-rante un test da sforzo.
La presenza di più fattori di rischio multipli è associata ad un rischio sostanzialmente aumentato di morte improvvi-sa e solitamente rappresenta un’ indicazione all’impianto dell’ ICD.
In pazienti selezionati, anche un singolo fattore di rischio può giustificare l’ impianto di un ICD.
Fattori di rischio
In pazienti con una storia familiare di morte improvvisa, definita come due o più morti improvvise in familiari giovani (<50 anni) di primo grado, è consigliabile l’im- pianto di un ICD.
In soggetti con famiglie con una sola morte improvvisa, l’indicazione all’ICD è più incerta ed è sostanzialmente basata su alcune considerazioni generali. È consigliabile tenere conto del profilo di rischio di ciascun familiare af- fetto, del grado di parentela tra il soggetto affetto ed il fa- miliare deceduto improvvisamente, e delle dimensioni della famiglia. Più stretto è il grado di parentela e più piccola è la famiglia, maggiore può essere considerata l’ indicazione all’impianto. Questo approccio tiene anche conto del possibile impatto psicologico che può avere sul paziente la morte improvvisa di un familiare affetto dalla stessa malattia, e della rassicurazione che l’ICD può garantire in termini di protezione dalla morte improvvisa.
Ipertrofia ventricolare sinistra massiva.
L’ipertrofia massiva del ventricolo sinistro (spessore massimo della parete ≥ 30 mm) è un importante indica-tore di rischio di morte improvvisa nei pazienti giovani con cardiomiopatia ipertrofica ed è associata ad un rischio a lungo termine di circa 20% a 10 anni. Dato che molti pazienti con ipertrofia massiva sono giovani, asintomatici ed hanno una funzione sistolica normale, l’impianto di un ICD dovrebbe essere preso in considera- zione.
Sincope di origine non spiegata (non vasova- gale).
La sincope non vasovagale è una delle presentazioni cliniche più difficili da gestire nei pazienti con
cardiomio- patia ipertrofica,dato che i principali meccanismi poten-zialmente responsabili per questi episodi sincopali sono molti ed includono tachiaritmie ventricolari o
sopra-ven-tricolari,bradiaritmie ed ostruzione dinamica all’eiezione. Poichè questi meccanismi possono causare la sincope sia isolatamente che in associazione con gli altri mecca-nismi,le
implicazioni prognostiche della sincope sono dif-ficili da determinare.
Tachicardia ventricolare non sostenuta.
Episodi di tachicardia ventricolare all’ Holter (≥ 3 battiti con frequenza ≥120/min) sono associati ad un significa-tivo aumento del rischio di morte improvvisa, particolar-mente in pazienti giovani (≤30 anni). Tuttavia, in assenza di altri fattori di rischio,brevi ed isolati episodi di tachicar-dia ventricolare su una singola registrazione Holter di 24 h non sembrerebbero rappresentare un importante indi-catore di aumentato rischio di morte improvvisa. Episodi prolungati (>10 battiti) e/o frequenti di tachicardia ven-tricolare non sostenuta, pur in assenza di dati sistematici, vengono considerati un indicatore più importante di ri-schio aumentato. Non vi sono dati disponibili riguardo alle implicazioni prognostiche di episodi di tachicardia ventricolare non sostenuta identificata su Holter ripetuti.
Anormale risposta della pressione arteriosa allo sforzo.
Un certo grado di incertezza rimane riguardo alle impli-cazioni prognostiche di una riposta ipotensiva al test da sforzo.Tuttavia, sembrerebbe plausibile che l’inclusione di questa variabile nel profilo di rischio generale del paziente possa migliorare la stratificazione del rischio.
Ostruzione all’eiezione.
Nei pazienti con cardiomiopatia ipertrofica,l’ostruzione di-namica all’eiezione è causata dal contatto tra i lembi mi-tralici e il setto interventricolare ipertrofico in sistole, ed è presente in circa il 20% dei pazienti in condizioni di ri-poso e in circa il 70% dei pazienti durante sforzo. L’ostru-zione all’eiezione può essere considerata un fattore di ri-schio minore ed è associata ad un modesto aumento del rischio di morte improvvisa.Quindi,sembrerebbe appro-priato includere anche questa caratteristica clinica nella valutazione del rischio generale del paziente.
Delayed enhancement identificato con risonanza magnetica cardiaca.
In questi ultimi anni vi è stato un crescente interesse ri-guardo al delayed enhancement, identificato dalla riso-nanza cardiaca,come potenziale indicatore di rischio di morte improvvisa nella cardiomiopatia ipertrofica.Il de- layed enhancement è rappresentativo di fibrosi miocardi- ca ed è stato ipotizzato che un miocardio con estesa fi-brosi possa essere a maggior rischio di aritmie ventrico- lari.Dati recenti hanno identificato una relazione tra de-layed enhancement e tachicardia ventricolare non soste-nuta all’Holter.Tuttavia, il delayed enhancement viene identificato in circa il 70% dei pazienti con cardiomiopatia ipertrofica e non vi sono ancora metodi standardizzati per quantificare il delayed enhancement in questa malat- tia. Quindi, il ruolo prognostico del delayed enhancement nella cardiomiopatia ipertrofica rimane da precisare.
Studio elettrofisiologico.
Non ha un ruolo importante nella stratificazione del ri- schio di morte improvvisa nella cardiomiopatia ipertrofi-ca,dato che può innescare una tachicardia ventricolare polimorfa o fibrillazione ventricolare anche in molti pazien ti clinicamente a basso rischio,mentre può non indurre aritmie ventricolari sostenute in pazienti a rischio partico-larmente elevato, quali quelli con un precedente arresto cardiaco. Quindi, lo studio elettrofisiologico non dovrebbe essere utilizzato nella stratificazione del rischio di morte improvvisa.
Linee guida AIAC all’impianto di pacemaker, dispo- sitivi per la resincronizzazione cardiaca, defibrillato- ri automatici e loop recorder update 2011. Maurizio Lunati, Massimo Santini (Co-chairmen) Maria Grazia Bongiorni, Giuseppe Boriani, Riccardo Cappato, Do- menico Corrado,Antonio Curnis,Matteo Di Biase, Ste- fano Favale, Luigi Padeletti, Roberto Pedretti, Ales- sandro Proclemer,Renato Ricci,Paolo Spirito, Giu- seppe Vergara GIAC–Vol 14 n.1–Gennaio- Marzo 2011
 Cuore Sano
Cuore Sano




