LA CARDIOMIOPATIA
IPERTROFICA
(Hypertrophic cardiomyopathy)
La Cardiomiopatia Ipertrofica è la malattia su base genetica familiare più frequente (1/500-1/1000); è la più frequente causa di morte improvvisa nei giovani e negli atleti. Essa è presente in tutte le regioni della terra; si stima che negli Stati Uniti siano circa 600.000 le persone che ne sono affette, di cui molte non sono diagnosticate.
Le varianti genetiche coinvolte nella malattia sono nume-rose, ma il suo fenotipo caratteristico è l’ipertrofia cardia-ca. Bisogna ricordare che alcuni pazienti, genotipicamen-te positivi per Cardiomiopatia Ipertrofica, possono essere fenotipicamente negativi.
Si ipotizza che il meccanismo attraverso il quale le di-verse
mutazioni genetiche culminano nelle manifestazio-ni morfologiche e cliniche della malattia sta in un difetto della generazione della forza contrattile del cuore con conseguente risposta
ipertrofica.
In pratica la definizione generalmente accettata di Cardiomiopatia Ipertrofica è una ipertrofia di uno o più segmenti delle camere ventricolari (destra o sini-stra),in assenza di una causa che possa giustificare, in modo convincente una tale condizione.
Nel bambino, trovare spessori cardiaci >2 volte la devia- zione standard rispetto alla media degli spessori per l'età e la superficie corporea, deve far sospettare questa op-zione diagnostica.
Nell’adulto,spessori cardiaci >15 mm sono associati usu-almente alla presenza di una Cardiomiopatia Ipertrofica. Spessori cardiaci intermedi (13-14 mm), in assenza di diagnosi alternative, sono considerati borderline, soprat-tutto se sono associati ad una familiarità per Cardiomio-patia Ipertrofica.La diagnosi differenziale deve essere po-sta con la cardiopatia ipertensiva, con alcune cardio-patie infiltrative e con il cuore di atleta. Queste condizio-ni sono le potenziali opzioni confondenti, in particolare quando lo spessore cardiaco è borderline.
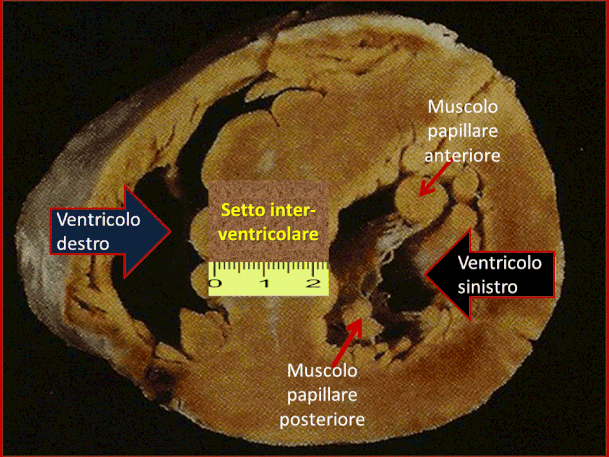
I reperti microscopici della Cardiomiopatia Ipertrofica sono caratterizzati da una ipertrofia miocardica e da una grossolana disorganizzazione delle fibre muscolari che mostrano una marcata dilatazione dei miociti e una di-sarray dei miociti con aumentata fibrosi interstiziale, vedi figura sottostante.

Le arterie intramurali sono alterate; esse hanno un notevole spessore delle pareti, a cui consegue una riduzione del lume che è verosimilmente responsabile della sintomatologia angi-nosa, delle aritmie ventricolari e della morte improvvisa.
Manifestazioni cliniche del paziente con Cardio-miopatia Ipertrofica.
I pazienti con Cardiomiopatia Ipertrofica sono spesso a- sintomatici o accusano sintomi atipici e fugaci; in questi casi essi vengono identificati in corso di uno screening dei familiari di un paziente con Cardiomiopatia Ipertrofi-ca. Purtroppo assai di frequente in particolare nei giovani la prima manifestazione clinica della malattia può essere la morte improvvisa.Poichè essa è legata allo sforzo ago-nistico, una diagnosi corretta con un esame ecocardio-grafico è fondamentale per sconsigliare tali attività.La malattia spesso è identificata in pazienti di 40-50 anni, ma è possibile riscontrarla anche a tarda età.Il sintomo più frequente è la dispnea, che è presente nel 90% dei pazienti sintomatici; nel 75% è presente angina pectoris; altri sintomi sono:palpitazioni,dispnea parossistica nottur-na; la sincope e la pre-sincope sono dovute all'incapacità del cuore ad adeguare la portata cardiaca alle esigenze metaboliche e alla comparsa di aritmie ventricolari.I bam-bini e gli adolescenti che hanno questi sintomi caratte-rizzano un gruppo di pazienti ad alto rischio di morte im-provvisa.Lo sforzo fisico fa peggiorare la sintomato-logia.
Quali mezzi diagnostici adoperare?
.Elettrocardiogramma
Assai di frequente l’elettrocardiogramma è anormale. Anche alcuni familiari di pazienti con cardiomiopatia iper- trofica, che sono portatori del difetto genetico respon-sabile della malattia, possono mostrare alterazioni elet- trocardiografiche in assenza di ipertrofia ventricolare sini- stra.Nei pazienti con cardiomiopatia ipertrofica ed ipertro- fia all’ecocardiogramma, le alterazioni elettrocardiogra- fiche includono un marcato aumento del voltaggio dell’ onda R, onde Q strette e profonde nelle derivazioni peri-feriche o nelle precordiali V4-V6 ed alterazioni della ripo-polarizzazione ventricolare con sottoslivellamento del tratto ST e/o onde T profonde e negative.Nell'esempio pubblicato da F. Cecchi, E. Servettini, B.Tomberli dell'U-niversità di Firenze, Centro di Riferimento Regio-nale per le Cardiomiopatie dell'azienda Ospedalie-ra Careggi di Firenze, l'ecg mostra onde Q profon-de in D1 e aVL, sopraslivellamento del tratto S-T in V1 e V2 e alterazioni diffuse dell'onda T.

In sintesi nella Cardiomiopatia ipertrofica l’ECG può pre-sentare alterazioni tipiche,come onde Q profonde,onde S profonde in V1-V3 o R alte in V4-V6 da ipertrofia ven-tricolare sinistra con alterazioni dell’onda T.Anche se non specifica,la presenza di onde T negative giganti può es-sere associata ad una localizzazione apicale dell’IVS. In molti casi sono presenti solamente alterazioni del tratto ST, con sotto o sopraslivellamento o dell’onda T,che può essere difasica o invertita. Nel 5-10% dei casi, l’ECG può risultare nei limiti della norma. In circa la metà dei casi le alterazioni sono atipiche ed aspecifiche,talvolta solo limi-tate ad un ritardo di conduzione intraventricolare o a una assenza di onda R in V2.In questi casi occorre fare una accurata anamnesi familiare ed un attento esame clinico, ed in particolare un esame ecocardiografico,che permet-ta di definire gli spessori parietali nelle diverse zone del VS,incluso aree come il setto posteriore,la parete latera-le, l’apice.
.Ecocardiogramma
La diagnosi di cardiomiopatia ipertrofica viene stabilita dalla dimostrazione ecocardiografica di un ventricolo sini-stro ipertrofico e non-dilatato in assenza di altre malattie cardiovascolari capaci di produrre una ipertrofia. Già in condizioni basali nel 20-25% si osserva una ostruzione dinamica all’eiezione, che può essere indotta con mano-vra di Valsalva nel 40-50% dei pazienti. L’ ostruzione all' eiezione è sostenuta dallo spostamento dei lembi mi-tralici nel tratto di efflusso durante la sistole. Di recente la presenza di ipertrofia ventricolare sinistra asimmetrica è stata documentata in pazienti con malattia di Danon e in pazienti con glicogenosi dovuta a mutazioni sul gene che codifica la gamma 2 subunità regolatoria della AMP-chi-nasi (gene PRKAG2). Una ipertrofia ventricolare sinistra simile a quella della cardiomiopatia ipertrofica si può tro-vare in pazienti in età pediatrica con la sindrome di Noonan o con atassia di Friedreich, o in pazienti con ma-lattia di Anderson Fabry. Quest’ultima malattia è causata da una deficienza legata al cromosoma X dell’enzima lisosomiale α-galattosidasi ed è solitamente associata ad ipertrofia ventricolare sinistra lieve ed asimmetrica.
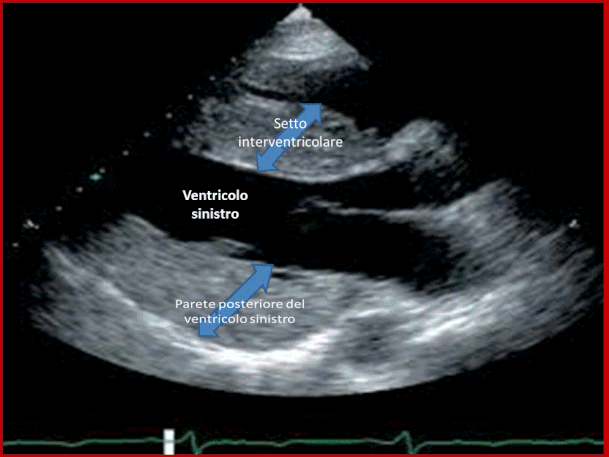
L’ostruzione all'eiezione è sostenuta dallo spostamento dei lembi mitralici nel tratto di efflusso durante la sistole. Di recente la presenza di ipertrofia ventricolare sinistra asimmetrica è stata documentata in pazienti con malattia di Danon e in pazienti con glicogenosi dovuta a mutazio-ni sul gene che codifica la gamma 2 subunità regolatoria della AMP-chinasi (gene PRKAG2).Una ipertrofia ventri-colare sinistra simile a quella della cardiomiopatia ipertro fica si può trovare in pazienti in età pediatrica con la sin-drome di Noonan o con atassia di Friedreich,o in pazienti con malattia di Anderson Fabry.Quest’ultima malattia è causata da una deficienza legata al cromosoma X dell’ enzima lisosomiale α-galattosidasi ed è solitamente as-sociata ad ipertrofia ventricolare sinistra lieve ed asim-metrica.
Altre cardiomiopatie associate ad immagini ecocardio-grafiche di ipertrofia ventricolare sinistra comprendono:
.l’amiloidosi cardiaca,vedi l'esempio nella fig. sottostan-te.

.la non-compaction del ventricolo sinistro,vedi l'esem-pio nella fig. sottostante.
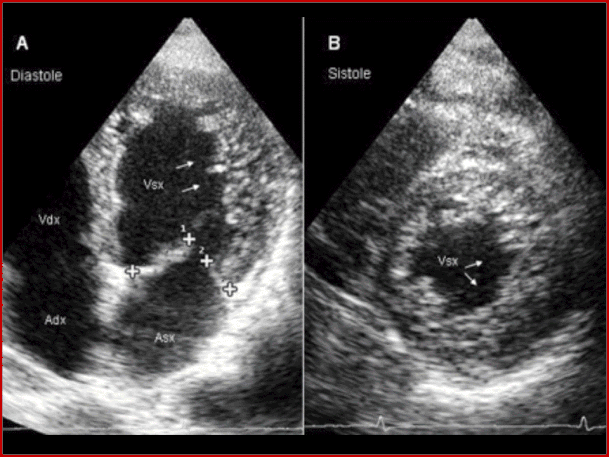
In sintesi la diagnosi di cardiomiopatia ipertrofica deve essere basata su una attenta valutazione ecocardiografi-ca della entità e distribuzione dell’ipertrofia ventricolare sinistra, del quadro clinico generale del paziente che in-clusa l’età del paziente e gli aspetti clinici compatibili con sindromi pediatriche e degli aspetti elettrocardiografici.
.Risonanza magnetica nucleare
In una piccola percentuale di casi con anormalità elettro-cardiografiche e che fanno pensare ad una cardiomio-patia ipertrofica e con un ecocardiogramma che non rie-sce ad identificare i segmenti ipertrofici, le immagini del cuore ad alta risoluzione ottenute con la risonanza ma-gnetica sono particolarmente utili nello stabilire la dia-gnosi di cardiomiopatia ipertrofica.
.Screening genetico L’analisi del DNA è divenuto il metodo definitivo per la diagnosi di molte malattie genetiche.E' noto che la car-diomiopatia ipertrofica è causata da mutazioni su 10 di-versi geni che codificano proteine del sarcomero car- diaco.

Mutazioni sulla catena pesante β della miosina e sulla proteina C che lega la miosina sono presenti in oltre il 70% dei pazienti con cardiomiopatia ipertrofica in cui il difetto genetico viene identificato.Ciononostante il difetto genetico responsabile della malattia viene identificato so-lo in circa la metà dei pazienti, probabilmente perché altri
geni non ancora identificati possono essere re-sponsabili della cardiomiopatia ipertrofica.Gli altri geni noti ritenuti responsabili della malattia inclu-dono i geni che codificano:la troponina T,la tropo-nina I, l’α-tropomiosina, le catene leggere regola-trici e le catene leggere essenziali della miosina, l’α-actina,la titina e la catena pesante α della mio-sina.
Quale è il management del paziente con Cardio-miopatia Ipertrofica?
Nel paziente asintomatico,l’impiego generale di farmaci (e in particolare dei β-bloccanti) è in classe IIb con un li-vello di evidenza C. In altri termini non vi sono studi ran-domizzati o osservazionali che supportino il beneficio di tale classe di farmaci nel paziente asintomatico e proba-bilmente il rischio di usare tali agenti supera il potenziale beneficio del loro impiego. Nel paziente asintomatico è importante cercare di curare le eventuali co-morbilità che possono contribuire alle patologie cardiovascolari (ad es. ipertensione arteriosa, diabete, dislipidemia, obesità, etc) e sarebbe da promuovere una attività fisica a bassa in-tensità con sforzo di tipo aerobico (Classe IIa).Risulta fondamentale educare ed informare il paziente ed il suo ambiente familiare circa l’evoluzione della malattia,i prin-cipali aspetti fisiopatologici ed i sintomi di allarme della malattia stessa.In tali pazienti,per il trattamento dell’ iper-tensione si dovrebbe preferire un β-bloccante.Tra i cal-cioantagonisti solo il verapamil è stato studiato siste-mamaticamente nella Cardiomiopatia Ipertrofica.
Dovrebbero essere evitati alte dosi di diuretici e di vaso-dilatatori.
Evidenze sperimentali su modelli animali, hanno evi- denziato che sia il trattamento con ACE-inibitori, sia le statine,sia il diltiazem si sono dimostrati efficaci nella pre-venzione della progressione della malattia ed in partico-lare sull’aumento dell’ ipertrofia cardiaca.
Nelle Linee Guida si sottolinea anche che
l’ impiego di questi agenti farmacologici dovrebbe essere riservato in caso di patologie concomitanti e non dovrebbero essere usati con l’intento di rallentare la progressione della car-
diomiopatia.
Nel paziente sintomatico il trattamento con β-bloccanti è il cardine della terapia, ponendosi in classe I, con un Livello di evidenza B. I β-bloccanti dovrebbero essere usati come “first line” di trattamento per migliorare il qua-dro clinico che si caratterizza per la presenza di dispnea ed angina, sia nei pazienti con Cardiomiopatia Ipertrofica ostruttiva,che nei pazienti con Cardiomiopatia non ostruttiva.La terapia β-bloccante deve essere titolata, partendo da basse dosi e ponendo attenzione in par-ticolare ai pazienti bradicardici o con turbe severe della conduzione.In generale,il target della frequenza cardiaca dovrebbe attestarsi intorno ai 60 b/m (Livello di evidenza B). In caso di mancato controllo dei sintomi e di una con-comitante intolleranza alla terapia β-bloccante, può esse-re impiegato il verapamil, iniziando da basse dosi e tito-landolo fino ad un dosaggio massimo di 480 mg/die.
Ovviamente l’impiego del verapamil deve essere attenta- mente valutato in caso di elevati gradienti all’efflusso ventricolare sinistro, sintomi di insufficienza cardiaca avanzata e in caso di bradicardia sinusale. I β-bloccanti, dal punto di vista fisiopatologico, risultano farmaci ottima-li nel trattamento di tale patologia per la loro caratteri-stica di essere farmaci inotropi negativi e per la loro ca-pacità di attenuare la tachicardia su base adrenergica e riflessa, tipica di questa malattia. Questi farmaci miglio-rano l’apporto di ossigeno e riducono pertanto l’ischemia miocardica. E questo è possibile perché fanno aumenta-re il tempo della fase diastolica facilitando così il riempi-mento cardiaco e migliorando la funzione diastolica, che come è noto è assai compromessa in tali pazienti.
La terapia con disopiramide può essere associata alla te-rapia β-bloccanti (in alternativa con verapamil) in caso di scarso controllo dei sintomi (Classe IIa, Livello di evi- denza B).
Nei bambini e negli adolescenti, l’ uso dei β-bloccanti è assolutamente indicato per ridurre i sintomi (in particola-re angina e dispnea), stando attenti tuttavia a monitora-re la performance nell'apprendimento scolastico, l’insor-genza di turbe depressive e il precoce affaticamento.
L’impiego dei diuretici deve essere riservato ai pazienti con sintomi di scompenso cardiaco refrattario, ponendo ovviamente la massima attenzione all’eventuale com-parsa di una ostruzione dinamica all’efflusso; essi devo-no essere affiancati a dosi massimali di β-bloccanti e/o verapamil (Classe IIa, Livello di evidenza C). Non devo-no essere impiegati calcioantagonisti diidropiridinici, po-tenzialmente pericolosi per l’insorgenza di sintomi in pa-zienti con Cardiomiopatia Ipertrofica Ostruttiva o con gra-diente all’efflusso provocabile.
La digitale non deve mai essere impiegata nella Car-diomiopatia Ipertrofica Ostruttiva,in particolare in ca-so di ritmo sinusale.
Non devono essere impiegati la disopiramide da sola (esaltazione della conduzione A-V, in caso di fibrillazione atriale) e tutti i farmaci inotropi (compresa la noradrena- lina).
L’efficacia di altre classi farmacologiche come gli ACE- inibitori, è controverso e necessita di ulteriori conferme e pertanto dovrebbero essere usati con cautela nei pa- zienti con Cardiomiopatia Ipertrofica.
Nei pazienti in cui vi sia una concomitante compromis-sione della funzione contrattile invece (< 50%) sono in-dicati i farmaci,che si sono dimostrati efficaci nello scom-penso cardiaco, tra questi, ovviamente, i β-bloccanti e gli ACE-inibitori.
In tali pazienti dovrebbe essere ricercata la presenza di altre cause corresponsabile di un eventuale calo di performance cardiaca, tra cui la cardiopatia ischemica (Classe I, Livello di evidenza rispettivamente B e C).
I β-bloccanti non sono usati per la prevenzione delle aritmie, reperto assai frequente nella cardiomiopatia iper-trofica (anche se l’effetto dei β-bloccanti si esplica anche in tal senso ed in particolare nella prevenzione della morte improvvisa). Per la prevenzione della morte im-provvisa è stato proposto un algoritmo volto a porre con adeguatezza le indicazioni ad un impianto del defibril-latore impiantabile (ICD) in pazienti portatori di Cardio-miopatia Ipertrofica.
Uno studio del 2014 ha valutato il rischio di morte im-provvisa e gli outcomes in 653 pazienti consecutivi con CMI senza fattori di rischio e pauci o asintomatici. Nel corso di un follow-up medio di 5,3 anni,35 pazienti (5,4%) sono deceduti per cause CMI-correlate.L'età me-dia al momento della morte era di 46 ± 20 anni nei pa-zienti che sono morti improvvisamente e 66 ± 15 e 72 ± 9 anni, rispettivamente, nei pazienti che sono morti per in-farto o ictus.L'incidenza di morte è stata dello 0,6% all' anno per morte improvvisa,0,2% annuo per insufficienza cardiaca e lo 0,1% all'anno per ictus. Il rischio di morte improvvisa era indipendente e inversamente correlato all' età, mentre il rischio di infarto o ictus era direttamente correlato all'età (p=0,020). A 10 anni dopo la valutazione iniziale, il rischio di morte improvvisa era del 5,9%, con un più basso tasso di morte improvvisa (0,3% per anno) in pazienti con normale dimensione atriale sinistra (≤ 40 mm).
In conclusione, nei pazienti con Cardiomiopatia Ipertrofi-ca senza fattori di rischio convenzionali e pauci-asinto-matici,il rischio di morte improvvisa ha un tasso di eventi del 0,6% all'anno. La morte per insufficienza cardiaca e o ictus era meno comune e in gran parte limitata a pazienti più anziani. American Journal of Cardiology, 2014, 113,9: 1550-1555.
RACCOMANDAZIONI IN BASE AI LIVELLI DI EVIDEN-ZA.
Le raccomandazioni cliniche derivano dalla revisione si-stematica di trials clinici randomizzati e vengono gra-duate in maniera differente a seconda se esista omoge-neità (grado A) oppure eterogeneità (grado B) tra i diver-si trials. In particolare l'eterogeneità è considerata clinica-mente significativa se tra due trials clinici randomizzati esiste una differenza nella riduzione del rischio relativo maggiore del 20%. Le raccomandazioni derivate invece dalla revisione sistematica di studi osservazionali (studi caso-controllo, studi di coorte), sono considerate più de-boli (grado C), per la frequente presenza nel disegno di questi studi di bias di diversa natura.

Prolungamento dell'intervallo tra il picco e la fine dell'onda T (T-peak to T-end-TpTe) ed aumento del rischio aritmico.
La cardiomiopatia ipertrofica si associa ad un aumentato rischio di morte cardiaca improvvisa per eventi aritmici ventricolari. Alcuni studi sembrano suggerire che un pro-lungamento dell' intervallo tra il picco e la fine dell' onda T (T-peak to T-end - TpTe) sia associato ad un aumento del rischio di aritmie ventricolari e morte improvvisa in diversi setting clinici, ma i dati relativi ai pazienti con cardiomiopatia ipertrofica sono limitati. Scopo di un recente studio tedesco è stato quello di valutare l'as-sociazione tra l'intervallo Tp-Te e gli eventi aritmici ven-tricolari in pazienti con cardiomiopatia ipertrofica, por-tatori di un defibrillatore impiantabile (ICD). Nello studio sono stati arruolati 40 pazienti, in prevalenza maschi (62,5%), di età media pari a 51,4 ± 16,4 anni. Nei pazienti è stato misurato l'intervallo TpTe in un elettrocardio-gramma a 12 derivazioni in ritmo sinusale e, ai succes-sivi controlli del defibrillatore, è stata analizzata la pre-senza di eventi aritmici ventricolari. Durante un follow-up di 41,8 ± 35,1 mesi, in 7 pazienti (17,5%) sono state rile-vate aritmie ventricolari appropriatamente trattate dal de-fibrillatore. In questi pazienti, l'intervallo TpTe aveva una durata significativamente più lunga rispetto ai pazienti senza eventi aritmici (101,3 ± 19,6 vs. 79,9 ± 15,3 ms; p = 0,004). La durata massima dell'intervallo si associava ad un elevato rischio di aritmie con un hazard ratio pari a 1,63 ogni 10 msec (CI 1,04-2,54, p = 0,031); nessun evento aritmico è stato rilevato nei pazienti con TpTe massimo ≤ 78 msec. Pertanto, secondo questi risultati, un prolungamento dell'intervallo TpTe si associa ad un maggior rischio di eventi aritmici ventricolari in pazienti con cardiomiopatia ipertrofica. L'intervallo TpTe potreb-be quindi rappresentare un marker di rischio aritmico in questi pazienti, utile per ottimizzare la stratificazione del rischio di morte cardiaca improvvisa. Clin Res Cardiol. 2017.

*p-value from Pearson chi-square test for catego-rical variables and t-test for continuous variables.
†Prolonged TpTe defined as > 85 ms; prolonged QTc defined as > 430 ms for males and > 450 ms for females [16];IVCD defined as QRSD≥120 ms; severe LVSD defined as ejection fraction ≤ 35%.
‡QRSD as reported on the ECG recording. TpTe and QT intervals were manually measured.
§For variables with missing values, proportions and p-values are calculated using the non-missing data as the denominator.
LVSD, Left ventricular systolic dysfunction; QRSD, QRS duration;QTc,corrected QT interval;SCD, sudden cardiac death; TpTe, Tpeak to Tend inter-val.
Tipi di cardiomiopatia ipertrofica
La cardiomiopatia ipertrofica è usualmente definita in base alla posizione della regione muscolare del cuore che risulta ispessita. La sintomatologia varia a seconda della regione muscolare interessata dall'ispessimento.
1-Ipertrofia apicale: l’area ispessita all'ispessimento è si-tuata all'apice del cuore,cioè nella parte inferiore del cuore.Questa condizione solitamente induce una riduzio-ne del volume del ventricolo.
2-Ipertrofia simmetrica: l’ispessimento interessa il ventri-colo sinistro interamente e ovviamente ne riduce il suo volume. Questo tipo di ipertrofia viene usualmente defi-nito "ipertrofia concentrica”.
3-Ipertrofia settale asimmetrica:l’ispessimento interessa il setto interventricolare del cuore. Questa tipo di ipertrofia può essere senza ostruzione.
4-Ipertrofia settale asimmetrica con ostruzione: l’ispessi-mento interessa anche in questo caso il setto interventri-colare,ma a differenza del tipo precedente, l’ispessi-mento provoca una ostruzione al flusso sanguigno dal cuore. Vedi capitolo sottostante.
CARDIOMIOPATIA IPERTROFICA
OSTRUTTIVA
(Hypertrophic obstructive cardiomyopathy)
E' una patologia che interessa un individuo per ogni 500.000 individui; è una patologia difficile da diagnosti-care, in quanto spesso è asintomatica. Rappresenta la più comune causa di morte improvvisa tra i giovani di età <35 anni e si caratterizza per un aumento dello spessore della parete del cuore, al punto da rendere difficoltoso il passaggio del sangue dal ventricolo all’aorta.
La diagnosi viene fatta quando viene diagnosticata un’ ipertrofia del ventricolo sinistro, in assenza di una causa che la sostenga come l' ipertensione arteriosa, la stenosi aortica, la stenosi sottovalvolari, etc.
Alcuni elementi rendono più probabile la diagnosi:
a) un pattern di ipertrofia di tipo asimmetrico, con interes-samento prevalente del setto interventricolare ed un rap-porto tra spessore del setto e della parete posteriore su-periore a 1,4;
b) un grado severo di ipertrofia, spesso associato a ridu-zione delle dimensioni della cavità ventricolare sinistro;
c) la presenza di ostruzione all’efflusso del ventricolo si-nistro associata ad insufficienza mitralica secondaria a movimento sistolico del lembo anteriore (SAM);
d) una compromissione della funzione diastolica.
QUALE TRATTAMENTO?
Dal punto di vista farmacologico i β-bloccanti, l’ amioda- rone, il verapamil e il diltiazem vengono diffusamente uti-lizzati per limitare i sintomi che sono caratterizzati da di-spnea e cardiopalmo.
Nei casi meno gravi, la terapia medica può risultare suffi- ciente.
Nei casi con sintomi importanti come:
.lipotimia,
.sincope da sforzo, provocate da un'inadeguata gittata cardiaca, a volte peggiorata da un gradiente del tratto di efflusso,
.presenza di aritmie, si può ricorrere all’intervento di miotomia cioè alla resezione del setto ipertrofico.
L’intervento chirurgico a cuore aperto consiste nell’ a-pertura dell’ aorta, nell’alcoolizzazione del setto inter- ventricolare con conseguente miomectomia o nell’ aspor-tazione del setto stesso, della valvola mitralica o della porzione di muscolo ispessito, in modo che la cavità del ventricolo sinistro in quest’ area venga allar-gata e l’ostruzione che blocca il flusso sanguino venga ri-dotta o eliminata.
Da alcuni anni, come alternativa all’ intervento chirurgico, è stata proposta la tecnica dell' ablazione percutanea del setto interventricolare, mediante iniezione selettiva di alcuni ml di alcool in un ramo settale dell’ arteria corona-rica interventricolare anteriore. Deve essere ribadito pe-rò che non vi sono evidenze che questi interventi inci-dano favorevolmente sulla sopravvivenza o che, nei pazienti asintomatici, ritardino la comparsa di sintomi maggiori o migliorino il decorso clinico della malattia.
*Evidenza di tipo A: evidenza supportata da studi controllati (randomizzati e non) ben disegnati e ben condotti e con consistente significatività statistica dei ri-sultati.
Evidenza di tipo B: evidenza scientifica supportata da studi osservazionali o da studi controllati ma con risultati di minore consistenza.
Evidenza di tipo C: non sono disponibili studi validi o i risultati non sono consistenti. Le raccomandazioni nelle Linee Guida sono supportate da opinioni di esperti.

ALGORITMI DI STRATIFICAZIONE DEL RISCHIO E TRATTAMENTO DELLA MORTE IMPROVVISA NEI PA-ZIENTI CON CARDIOMIOPATIA IPERTROFICA.
L'obiettivo di questo studio era di valutare la potenza degli attuali algoritmi di stratificazione del rischio di morte cardiaca improvvisa (ACC/ESC del 2003 e ACC Foun-dation/AHA del 2011). Sono stati studiati 1.606 pazienti consecutivi con cardiomiopatia ipertrofica in uno studio osservazionale di coorte retrospettivo. Cinque fattori di ri-schio per cardiomiopatia ipertrofica sono stati valutati:
.tachicardia ventricolare non sostenuta,
.grave ipertrofia ventricolare sinistra,
.storia familiare di morte cardiaca improvvisa,
.sincope inspiegata,
.anomala risposta pressoria all' esercizio fisico.
Nel corso di un follow-up di 11.712 pazienti all'anno (mediana 6,6 anni), una cardiomiopatia ipertrofica/ ap- propriata scarica di ICD si è verificata in 20 (3%) di 660 pazienti senza fattori di rischio (tasso annuo di 0,45%), 31 (4,8%) di 636 pazienti con 1 fattore di rischio (tasso annuo di 0,65%), 27 (10,8%) di 249 pazienti con 2 fattori di rischio (tasso annuo 1,3%), 7 (13,7%) di 51 pazienti con 3 fattori di rischio (tasso annuo 1,9%) e 4 (40%) di 10 pazienti con ≥ 4 fattori di rischio (tasso annuo 5,0%). Il rischio di morte cardiaca improvvisa è aumentato nei pazienti con più fattori di rischio (2 RF: HR 2,87, p ≤ 0,001; 3 RF: HR 4,32, p = 0,001; ≥ 4 RF: HR 11,37, p<0,0001), ma non in quelli con un singolo fattore di ri- schio (HR 1,43 p = 0.21). La probabilità di identificare correttamente un paziente a rischio di cardiomiopatia ipertrofica sulla base del profilo del fattore di rischio era 0,63 a 1 anno e 0,64 a 5 anni per l' algoritmo ACC/ESC 2003 e 0,61 al 1 anno e 0,63 a 5 anni per quello ACCF/ AHA 2011.
Lo studio conclude che gli algoritmi ACC/ESC del 2003 e ACC Foundation/AHA del 2011 distinguono i pazienti ad alto e basso rischio con potenza limitata. Heart 2013; 99: 534-541.
Incidenza di morte cardiaca improvvisa dopo abla- zione alcolica settale.
Un recente studio ha valutato la sopravvivenza e l'in- cidenza di morte cardiaca improvvisa dopo ablazione alcolica settale nonché gli effetti sui fattori di rischio tradizionali per morte cardiaca improvvisa. Sono stati arruolati 470 pazienti consecutivi (età media 56 ± 14 anni) con cardiomiopatia ipertrofica ostruttiva. La soprav-vivenza a 10 anni è stata del 88% (mortalità annua per tutte le cause 1,2%) dopo ablazione alcolica settale rispetto al 84% (p=0,06) di una popolazione di base abbinata. La sopravvivenza a 10 anni senza morte car-diaca improvvisa è stata del 95% (tasso annuale di morte cardiaca improvvisa del 0,5%). L' ablazione alcolica set-tale ha ridotto la prevalenza di anomala risposta presso-ria arteriosa (dal 23% al 9%, p<0.001), sincope (26% al 2%, p < 0,001), tachicardia ventricolare non sostenuta (23% al 17%, p<0,05) e spessore massimo ≥ 30 mm (7% al 2%, p<0,001). Una storia familiare di morte cardiaca improvvisa era presente nel 19% dei pazienti. La per-centuale di pazienti a rischio elevato (con due o più fattori di rischio - n = 89), è stata ridotta dal 25% all' 8% (p < 0,001). Un punteggio relativo ai fattori di rischio ≥ 2 prima dell' ablazione alcolica set-tale non era associato a morte cardiaca improvvisa (n=361,p = 0,31). Heart 2013; 99:1012-1017.
BAMBINI E ADOLESCENTI CON CARDIOMIOPATIA IPERTROFICA TRATTATI CON DEFIBRILLATORI IMPIANTABILI.
Un recente studio ha valutato l' efficacia dei defibrillatori (ICD) nei bambini e negli adolescenti con cardiomiopatia ipertrofica (CMI).
È stato realizzato un registro multicentrico internazionale di impianti con ICD (dal 1987 al 2011) in 224 bambini e adolescenti con CMI giudicati ad alto rischio di morte improvvisa. Essi hanno ricevuto un ICD in prevenzione primaria (n = 188) o secondaria (n = 36) in base ad una valutazione di 22 istituzioni negli Stati Uniti, Canada, Australia e Europa. I defibrillatori sono stati attivati in mo-do appropriato per arrestare una tachicardia ventri-colare o una fibrillazione ventricolare in 43 su 224 pazienti (19%) oltre una media di 4,3 ± 3,3 anni. I tassi di inter-vento dell' ICD sono stati complessivamente del 4,5% all'anno, il 14,0% all'anno per la prevenzione secondaria dopo un arresto cardiaco e il 3,1% all'anno per la pre-venzione primaria sulla base di fattori di rischio. Il tempo medio per un impianto alla prima scarica appropriata è stato di 2,9 ± 2,7 anni (intervallo da 8,6 anni).
In prevenzione primaria, la probabilità di una scarica per arresto di una tachicardia ventricolare o una fibrillazione ventricolare è stata la stessa nei pazienti sottoposti a impianto per 1,2 o ≥ 3 fattori di rischio (12 su 88 [14%], 10 di 71 [14%], e 4 su 29 [14%], rispettivamente, p = 1,00). Una ipertrofia ventricolare sinistra estrema è stata il più comune fattore di rischio presente (da sola o in combinazione con altri markers) nei pazienti con impian-to in prevenzione primaria (17 di 26 [65%]). Complicanze ICD-correlate, in particolare scariche inappropriate o malfunzionamenti degli elettrodi, si sono verificate in 91 pazienti (41%) a 17 ± 5 anni.
In conclusione, in una corte pediatrica con CMI ad alto ri- schio, interventi dell'ICD per l'arresto di tachiaritmie ven- tricolari mortali sono frequenti. Una ipertrofia ventricolare sinistra estrema si associa più frequentemente a sca-riche appropriate. Tuttavia,il tasso di complicanze del de-vice limita le decisioni di un impianto di un ICD in questa fascia di età, JACC 2013, Volume 61/ Issue 14.
L'esercizio fisico nella cardiomiopa-tia ipertrofica
Dati recenti hanno dimosrato che l'esercizio fisico (ET) determina significativi miglioramenti sulla sintomatologia e sulla funzionalità nei pazienti con disfunzione diastolica e, quindi si ipotizza che possa essere utile nei pazienti con cardiomiopatia ipertrofica.Poichè non ci sono dati sulla sicurezza e sull'efficacia dell' ET in pazienti con cardiomio-patia ipertrofica, in un lavoro prospettico non ran-domizzato sono stati arruolati 20 pazienti con car-diomiopatia ipertrofica sintomatica,limitati nell'at-tività di tutti i giorni in modo significato,in un pro-gramma sorvegliato di esercizi di riabilitazione cardiaca.I pazienti di età 62 ± 13 anni erano sud-divisi nelle classi funzionali NYHA nel seguente modo:classe funzionale II (35%) e III (65%). Avevano una dimensione media del setto inter-ventricolare di 17 ± 5 mm e una frazione di eie-zione ventricolare sinistra di 53±15%.Sei pazien-ti avevano un defibrillatore impiantabile. La pre-scrizione all’esercizio era basata sulla frequen-za cardiaca di riserva determinata da un test da sfor-zo incrementale limitato dai sintomi. L’intensità dell’esercizio è stata gradualmente aumentata dal 50% al 85% della massima frequenza rag-giunta durante il test da sforzo. I pazienti hanno comple-tato una media di 41±8 ore di attività aerobica. Non si sono verificati eventi avversi o aritmie ven-tricolari sostenute. La capacità funzionale, valu-tata con un test da sforzo graduale, è migliorata da 4,7 ± 2,2 a 7,2 ± 2.8 equivalenti metabolici (MET) (p = 0,01). La classe funzionale NYHA è migliorata rispetto al basale di 1 grado o più in 10 pazienti (50%) e nessun deterioramento è stato registrato durante il follow-up. Gli Autori hanno concluso come il presente studio possa suggerire che i pazienti con cardiomiopatia ipertrofica, che rimangono sintomatici nonostante la terapia me-dica,possono raggiungere un miglioramento fun-zionale considerevole attraverso un programma di esercizio fisico sorvegliato.
Efficacy of exercise training in symptomatic pa-tients with hypertrophic cardiomyopathy: Results of a structured exercise training program in a car-diac rehabilitation center. Robert Klempfner et Al European Jornal of Preventive Cardilogy 2015, 22,1: 13-19
Aritmie causate dalla cardiomiopatia ipertrofica
Esse includono:
1-Fibrillazione atriale: è causata dalla interruzione degli impulsi elettrici che nel soggetto normale stimolano la contrazione del muscolo cardiaco.In questa aritmia un numero enorme di impulsi elettrici viene prodotto dalle pareti atriali, con conseguente movimento molto rapido e non coordinato, che rendono meno efficiente la pompa del sangue. Soltanto alcuni di questi stimoli passano nei ventricoli e rendono il ritmo cardiaco veloce e completa-mente irregolare. La Fibrillazione atriale può aumentare il rischio di coaguli di sangue nell'atrio sinistro, che favorire l'insorgenza di ictus cerebri.
2-Tachicardia ventricolare è caratterizzata da una frequenza cardiaca rapida che può impedire al cuore di riempirsi efficacemente di sangue al punto da portare una riduzione della gittata sistolica con perdita di coscienza.
3-Fibrillazione ventricolare è caratterizzata da impulsi fre-quenti e irregolari che fanno sì che i ventricoli si contrag-gano in modo che il sangue non venga pompato effica-cemente dal cuore.Questa condizione è pericolosa per la vita in quanto può causare arresto cardiaco e richiedere un trattamento urgente con un defibrillatore.
 Cuore Sano
Cuore Sano




